Magnesium und NMDA-Rezeptor: Die Fakten
Der NMDA-Rezeptor ist unter anderem an der Gehirnentwicklung, der Lernfähigkeit und dem Gedächtnis beteiligt. Weiterhin ist erwiesen, dass verringerte Magnesiumwerte mit zahlreichen neurologischen Erkrankungen assoziiert sind. In diesem Artikel möchten wir Ihnen die Funktionen des NMDA-Rezeptors und den Nutzen von Magnesium in der therapeutischen Praxis erläutern.
Gehirnzellen kommunizieren mithilfe von Neurotransmittern. Diese Signalsubstanzen transportieren unter anderem Nervenimpulse in die Synapsen zwischen den Neuronen des Nervensystems. Sie aktivieren Rezeptoren in den Nervenzellmembranen, sodass Informationen zwischen den Nervenzellen weitergegeben werden können.
Der NMDA-Rezeptor (N-Methyl-D-Aspartat) ist ein Protein, das gewissermaßen ein Verbindungsglied zwischen den Synapsen und dem intrazellulären Raum postsynaptischer Neuronen darstellt. Diese Verbindung erfolgt über einen Ionenkanal, der durch die Zellmembran verläuft. NMDA-Rezeptoren sind wichtig für die neuronale Entwicklung und Synapsenbildung und spielen eine Rolle bei der Informationsübertragung. Unter pathologischen Bedingungen kann der NMDA-Rezeptor jedoch überaktiv werden und Neuronen schädigen (Zoutewelle, 2017).
Im folgenden Abschnitt möchten wir kurz genauer auf die biochemische Ebene der Funktion des NMDA-Rezeptors eingehen. Dies ist jedoch ein recht komplexes und fachspezifisches Thema. Wer sich nur darüber informieren möchte, welche Folgen eine Über- oder Unteraktivität des NMDA-Rezeptors für den Klienten hat und wie diese positiv beeinflusst werden können, kann diesen Abschnitt auch überspringen und direkt beim Abschnitt „Pathologie“ weiterlesen.
Funktion des NMDA-Rezeptors auf biochemischer Ebene
Im deaktivierten Zustand – bei normalen Membranpotenzialen – wird der Ionenkanal des NMDA-Rezeptors durch Magnesium blockiert (Baaij 2015). Membrandepolarisation, eine Veränderung der Ladung der Zellmembran, kann auftreten, wenn sich die elektrische Ladung innerhalb und/oder außerhalb der Zelle ändert. Membrandepolarisation beeinflusst die in die Membran eingebetteten Proteinstrukturen wie den NMDA-Rezeptor: Durch sie entsteht die Möglichkeit für das Ausströmen des Magnesiumions (Mg2+) aus dem Ionenkanal (Beecham 2015).
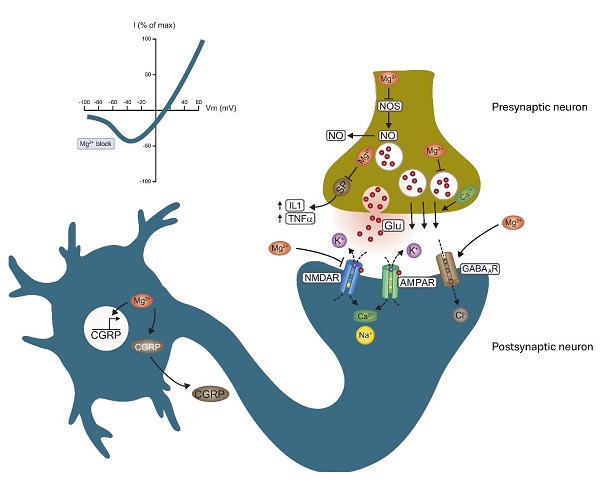
Abbildung 1.NMDA-Rezeptor (NMDAR) am postsynaptischen Neuron (aus Baaij 2015).
Zur Aktivierung des NMDA-Rezeptors ist jedoch nicht nur die Depolarisation der Membran erforderlich, sondern auch die Bindung seines selektiven Liganden N-Methyl-D-Aspartat (NMDA), der ausschließlich an den NMDA-Rezeptor bindet, und/oder Glycin und Glutamat an die NR1- und NR2-Untereinheiten des Rezeptors (Furukawa 2005). Der NMDA-Rezeptor weist eine hohe Sensitivität gegenüber Glutamat auf, die seine Sensitivität gegenüber NMDA sogar noch übersteigt (Monaghan 2009). Die Ligandenbindung führt zur ligandeninduzierten Ionenkanalöffnung. Dadurch tritt Magnesium aus dem Ionenkanal aus und es entsteht ein spannungsabhängiger Strom von Kationen (positiv geladenen Ionen). Natrium (Na+)- und Calcium (Ca2+)-Ionen strömen in die Zelle hinein und Kalium (K+) strömt aus der Zelle heraus. Dies hat das Einsetzen von Signaltransduktionskaskaden zur Folge (Furukawa 2005). Welche Wirkung durch eine solche Signaltransduktion ausgelöst wird, hängt vom jeweils aktivierten Signalweg ab. Dabei kann es sich sowohl um aktivierende als auch um hemmende Wirkungen handeln.
Die Deaktivierung eines aktivierten NMDA-Rezeptors erfolgt über einen entgegengesetzten Mechanismus. Die Aktivierung des NDMA-Rezeptors erzeugt auf verschiedene Weisen eine negative Rückkopplungsschleife (Vullhorst 2015), unter anderem durch Stimulation des hemmenden Neurotransmitters GABA. Über GABA-erge Rezeptoren in der Zellmembran von Neuronen (GABAAR, siehe Abbildung 1) bewirkt GABA durch Zustrom von Chlorid (Cl-) in die Zelle eine Membranpolarisation (Hyperpolarisation, Gegenteil von Depolarisation, Baaij 2015), sodass Magnesium in den Ionenkanal des NMDA-Rezeptors zurückkehren kann. Glycin übt über die Glycinrezeptoren an der Zellmembran von Neuronen eine ähnliche Wirkung aus und auch Taurin kann über die GABA- und Glycinrezeptoren eine vergleichbare Wirkung ausüben (Pellicer 2007, Song 2015). Taurin bindet außerdem direkt an den NMDA-Rezeptor und wirkt somit hemmend auf seine Funktion (Chan 2013, Chan 2014).
Pathologie
Magnesium, Taurin, Glycin, Glutamat und GABA spielen eine entscheidende Rolle bei der Funktion des NMDA-Rezeptors. Angesichts der vielen Prozesse, die durch den NMDA-Rezeptor reguliert werden, ist es naheliegend, davon auszugehen, dass ein Mangel dieser Substanzen gravierende Folgen auslösen kann. Ein NMDA-Rezeptor, der unzureichend aktiv ist, zum Beispiel aufgrund eines Mangels an rezeptoraktivierenden Substanzen, übt keine stimulierende Wirkung auf Neuronen aus, was zu Lern- und Konzentrationsschwierigkeiten führen und auch bei Neurodegeneration und Schizophrenie einen bedeutenden Faktor darstellen kann (Newcomer 2000). Ein NMDA-Rezeptor, der mangels hemmender Substanzen überaktiv ist, stimuliert die Neuronen zu stark, was zu Überreizung und Schädigung mit möglicher Excitotoxizität und zu neurodegenerativen Störungen führen kann (Choi 1988). Erhöhte Calciumkonzentrationen in Zellen infolge eines übermäßigen Calciumzuflusses, der durch erhöhte Aktivität der NMDA-Rezeptoren ausgelöst wird, erhöhen wahrscheinlich das Risiko für mitochondriale Schäden und Bildung von reaktiven Sauerstoffpartikeln (ROS), die oxidative Schäden verursachen können. In Extremfällen kann es dabei vermutlich sogar zu Hirnschäden und Apoptose kommen (Adam-Vizi, 2010 & Wang, 2018). Da NMDA-Rezeptoren sowohl aktivierende als auch hemmende Prozesse steuern und diese Prozesse sich gegenseitig beeinflussen, können sich die konkreten Folgen einer Unter- oder Überstimulation von NMDA-Rezeptoren in unterschiedlichster Weise äußern.
Magnesium assoziiert mit Hirnerkrankungen
Magnesium spielt eine zentrale Rolle bei der Beruhigung übererregter NMDA-Rezeptoren, da es den Ionenkanal im Rezeptor blockiert. Diese Blockierung stellt sicher, dass keine weiteren Ionen in das System gelangen oder es verlassen können und somit keine Signalübertragung stattfindet. Magnesium verhält sich daher als ein Antagonist. Aufgrund dieser zentralen Bedeutung von Magnesium für die Funktion des NMDA-Rezeptors werden wir uns hier nun näher mit den Folgen von Magnesiummangel im Zusammenhang verschiedener Hirnerkrankungen befassen. Eine zunehmende Zahl von Studien zeigt, dass ein Zusammenhang zwischen verringerten Magnesiumwerten und verschiedenen neurologischen Erkrankungen wie Migräne, Depressionen, Epilepsie und Alzheimer hergestellt werden kann (Baaij, 2015 & Wenwen, 2019).
Migräne
Forscher haben niedrigere Magnesiumwerte im Liquor mit Migräne in Verbindung gebracht. Migränekopfschmerz ist die Folge einer Cortical Spreading Depression (CSD). Diese CSD kann durch Aktivierung des NMDA-Rezeptors ausgelöst werden. Dies könnte der Grund dafür sein, dass Patienten mit erhöhter Reizbarkeit der Nerven anfälliger für Migräneanfälle sind (Chan, 2014 & Baaij, 2015 & Wenwen, 2019).
Depression
Einige Wissenschaftler vertreten die Auffassung, dass Magnesium Depressionen durch Blockierung des NMDA-Rezeptors lindern kann. Der NMDA-Rezeptor spielt möglicherweise eine Rolle bei der Pathologie von Depressionen (Baaij, 2015).
Epilepsie
Mehrere Studien zeigen, dass bei Epilepsiepatienten verringerte Magnesiumblutspiegel auftreten. Der Zusammenhang zwischen dem Magnesiumstatus und der Entwicklung von Anfällen kann durch die Rolle des Magnesiums bei der Blockade des NMDA-Rezeptors erklärt werden (Baaij, 2015).
Schlaganfall
Hirnblutungen und -infarkte sind häufige Todesursachen in den Industriestaaten. Auch hier wurde ein Zusammenhang mit einem verringerten Magnesiumstatus gefunden. Dieser Zusammenhang kann auf verschiedene Weise erklärt werden. Ein niedriger Magnesiumstatus erhöht die Aktivität des NMDA-Rezeptors und sorgt dadurch für eine erhöhte Zufuhr von Calcium und Glutamat. Dies kann die bei Schlaganfällen auftretenden Nervenschäden erklären (Baaij, 2015 & Wenwen, 2019).
Traumatische Hirnschäden
Bei Patienten mit traumatischen Hirnschäden und Rückenmarksverletzungen wird häufig ein Magnesiummangel festgestellt. Geringe Mengen an Magnesium in der Hirn-Rückenmarks-Flüssigkeit führen zu einer Erhöhung des oxidativen Stresses und der Fettsäure-Peroxidation, welche beide zur Schwere des Schadens beitragen (Baaij, 2015).
Parkinson
Parkinsonpatienten zeigen verringerte Konzentrationen von Magnesium im Cortex, der weißen Substanz, den Basalganglien und im Hirnstamm. Bei Tieren wurde nachgewiesen, dass eine chronisch verringerte Zufuhr von Magnesium zu einem signifikanten Verlust von dopaminergen Neuronen führt. Auch Parkinson ist durch den Verlust von dopaminergen Neuronen gekennzeichnet. Diese und andere Studien könnten darauf hindeuten, dass eine ausreichende Aufnahme von Magnesium von Vorteil für Parkinsonpatienten ist (Baaij, 2015 & Wenwen, 2019).
Alzheimer
Wie bereits beschrieben, kann eine erhöhte NMDA-Aktivität zu Excitotoxizität führen und den Zelltod fördern. Möglicherweise liegt dieser Mechanismus der neurodegenerativen Erkrankung der Alzheimer-Krankheit zugrunde (Zhang, 2016 & Wang, 2018 & Wenwen, 2019). Niedrige Konzentrationen von Serummagnesium werden auch mit anderen neurologischen Erkrankungen einschließlich Schizophrenie, bipolarer Störung, Neurose, Suchtanfälligkeit und Stress in Zusammenhang gebracht. Dies deutet darauf hin, dass Magnesiummangel eine wichtige Rolle bei der Ätiologie dieser Krankheiten spielt. Die Blockierung von NMDA-Rezeptoren mit Magnesium könnte theoretisch bei der Behandlung solcher Krankheiten von Nutzen sein. Die zurzeit vorliegenden Ergebnisse sind jedoch vorwiegend epidemiologisch. Bislang wurden noch keine aussagekräftigen klinischen Studien durchgeführt, um die Wirkung von Magnesium auf diese Erkrankungen zu untersuchen.
Lebensstil- und SupplementierungsinterventionenPreven
In den letzten Jahrzehnten wurden jedoch mehrere Beobachtungs- und kleine Interventionsstudien durchgeführt, die hinsichtlich der oralen Magnesiumsupplementierung zur Linderung von Migräneanfällen und Schmerzen vielversprechende Ergebnisse lieferten. Jedoch wird eine groß angelegte Studie benötigt, um die Bedeutung von Magnesium bei der Prävention und Behandlung von Depressionen noch eindeutiger zu belegen. Und leider fehlen bislang auch noch große RCTs zur Implementierung von Magnesium als Antiepileptikum (Baaij, 2015). In einer kleinen Studie an 30 Patienten mit traumatischen Hirnverletzungen zeigte sich, dass durch Magnesiumsupplementierung bessere Ergebnisse auf der Glasgow Outcome Scale (GOS) zu erzielt werden konnten. Diese Skala liefert ein objektives Maß für den Grad der Erholung nach einem Hirntrauma (Dhandapani, 2008).
Es zeigt sich mehr als deutlich, dass Menschen in den westlichen Ländern nicht genügend Magnesium mit der Nahrung aufnehmen. In Amerika nehmen zum Beispiel nur 60 Prozent der Bevölkerung ausreichend Magnesium mit der Nahrung auf. Dies ist unter anderem auf die Auslaugung der Böden (20-30 Prozent) und das Verlorengehen großer Mengen des in der Nahrung enthaltenen Magnesiums durch industrielle Verarbeitung zurückzuführen (Baaij, 2015), aber auch auf falsche Ernährungskonzepte (zum Beispiel unzureichender Verzehr von grünem Blattgemüse). Zudem müssen täglich große Mengen von Stress und Informationsreizen bewältigt werden. Allein die Augen müssen jeden Tag 10.000.000 Bit pro Sekunde an Informationen verarbeiten (Norretranders, 1999). Dies erfordert nicht nur eine hohe Verarbeitungskapazität des zentralen Nervensystems und damit der NMDA-Rezeptoren, sondern erzeugt auch einen hohen Energiebedarf. Magnesium ist für die Erzeugung von ATP, das die von den Körperzellen, benötigte Energie liefert, unentbehrlich, sodass es bereits aus diesem Grund essenziell ist.
Wenn im Gehirn zu wenig Magnesium und zu viel Glutamat, das verarbeiteten Nahrungsmitteln häufig als Geschmacksverstärker zugesetzt wird, vorhanden sind, ist durchaus naheliegend, dass unter diesen Umständen ein erhöhtes Risiko neurologischer Erkrankungen besteht. Es liegt dann nämlich eine negative Kombination aus einem Überschuss an stimulierender Substanz und einem Mangel an hemmender Substanz vor. Neben gezielter Supplementierung zur Wiederherstellung des Gleichgewichts zwischen diesen Substanzen können auch Lifestyle-Interventionen gut zur Unterstützung eingesetzt werden. Dazu zählen unter anderem der Abbau und die Prävention von Stress, die Sicherstellung ausreichender Entspannung sowohl am Arbeitsplatz (Pausen) als auch zu Hause, ausreichende Bewegung und die Einschränkung des Verzehrs von Kuchen und sonstigem Gebäck sowie salzhaltigen Snacks und anderen Produkten, die Salzersatzstoffe in Form von Glutamat und/oder Zusatzstoffe mit den E-Nummern 620-625 enthalten. Die E-Nummern der in Produkten enthaltenen Zusatzstoffe müssen auf der Verpackung angegeben werden.
Symptome von Magnesiummangel
Vorbeugend und bei Symptomen von Magnesiummangel kann es ratsam sein, zusätzliche Supplementierung anzuwenden. Zu möglichen Symptomen von Magnesiummangel zählen:
• Zittern und Muskelkrämpfe
• Zuckungen
• Psychische Störungen, Apathie, Delirium
• Osteoporose
• Müdigkeit und Muskelschwäche
• Hoher Blutdruck
• Asthmasymptome
• Herzrhythmusstörungen
Wenn Sie sich für Supplementierung mit Magnesium entscheiden, sollten Sie sicherstellen, dass es sich um eine gut aufnehmbare Form handelt. In Kürze werden Sie hier noch mehr darüber erfahren, also vergessen Sie nicht, regelmäßig unseren Newsletter zu lesen.
GABA und Taurin
Weiterhin kann es sinnvoll sein, eine vorübergehende GABA-Supplementierung durchzuführen. Bei einer Überaktivität von Neuronen stellt GABA das natürliche Gleichgewicht wieder her, indem es die Tätigkeit der überaktiven Neuronen hemmt. Mehr über diesen Neurotransmitter erfahren Sie in unserer Monographie zu GABA. Taurin ist strukturell mit dem hemmenden Neurotransmitter GABA verwandt und übt daher unter anderem auch eine agonistische Wirkung auf GABA aus. Zudem wirkt es in entgegengesetzter Weise wie die excitatorische Glutaminsäure.
Schlussbemerkung
Der NMDA-Rezeptor spielt eine wichtige Rolle bei der Gehirnentwicklung sowie bei Lern- und Gedächtnisprozessen und kann in pathologischen Situationen zu Neurodegeneration beitragen. Magnesium wirkt durch Blockierung des Ionenkanals als Antagonist des NMDA-Rezeptors, mit der Folge, dass keine Signalübertragung über den NMDA-Rezeptor stattfindet. Gemeinsam mit Glycin, Taurin, Glutamat und GABA sorgt Magnesium für einen gut funktionierenden NMDA-Rezeptor und trägt so zur guten Kommunikation zwischen Neuronen und zu gut funktionierenden Gehirnprozessen bei. Ausreichende Entspannung und Bewegung, Einschränkung des Konsums von Glutamat und eine abwechslungsreiche Ernährung, eventuell ergänzt durch eine Magnesiumergänzung in Kombination mit Glycin und Taurin, können zur normalen Funktion des NMDA-Rezeptors beitragen.
Quellen
[1] Adam-Vizi (2010). Calcium and Mitochondrial Reactive Oxygen Species Generation: How to Read the Facts. J Alzheimers Dis. 2010; 20(Suppl 2): S413–S426. doi: 10.3233/JAD-2010-100465
[2] Beecham (2015). The Possible Link between Autism and Glyphosate Acting as Glycine Mimetic - A Review of Evidence from the Literature with Analysis. J Mol Genet Med 2015, 9:4 doi.org/10.4172/1747-0862.1000187
[3] Chan et al (2013). Direct interaction of taurine with the NMDA glutamate receptor subtype via multiple mechanisms. Adv Exp Med Biol. 2013;775:45-52. doi: 10.1007/978-1-4614-6130-2_4.
[4] Chan (2014). Glutamate receptor antagonists in the management of migraine. Drugs. 2014Jul;74(11):1165-76. doi: 10.1007/s40265-014-0262-0.
[5] Chan et al (2014). Modes of direct modulation by taurine of the glutamate NMDA receptor in rat cortex. Eur J Pharmacol. 2014 Apr 5;728:167-75. doi: 10.1016/j.ejphar.2014.01.025. Epub 2014 Jan 28.
[6] Choi (1988). Glutamate neurotoxicity and diseases of the nervous system. Neuron. 1988;1:623–634.
[7] Dhandapani (2008). Randomized controlled trial of magnesium sulphate in severe closed traumatic brain injury. Indian J Neurotrauma 5: 27–33, 2008.
[8] Furukawa, H., Singh, S. K., Mancusso, R., & Gouaux, E. (2005). Subunit arrangement and function in NMDA receptors. Nature, 438(7065), 185–192.
[9] Monaghan (2009). Pharmacology of NMDA Receptors. In: Van Dongen AM, editor. Biology of the NMDA Receptor. Boca Raton (FL): CRC Press/Taylor & Francis; 2009. Chapter 12.
[10] Newcomer, J. W., Farber, N. B., & Olney, J. W. (2000). NMDA receptor function, memory, and brain aging. Dialogues in clinical neuroscience, 2(3), 219–232.
[11] Norretranders (1999). The User Illusion. Cutting Consciousness Down to Size. Tor Norretranders (Author) ISBN: 0-14-023012-2. p.143
[12] Pellicer et al (2007). Taurine in the anterior cingulate cortex diminishes neuropathic nociception: a possible interaction with the glycine(A) receptor. Eur J Pain. 2007 May;11(4):444-51. Epub 2006 Aug 2.
[13] Song et al (2015). Interaction between taurine and GABA(A)/glycine receptors in neurons of the rat anteroventral cochlear nucleus. Brain Res. 2012 Sep 7;1472:1-10. doi: 10.1016/j.brainres.2012.07.001. Epub 2012 Jul 13.
[14] Vullhorst et al (2015). A negative feedback loop controls NMDA receptor function in cortical interneurons via neuregulin 2/ErbB4 signalling. Nature communications, 6, 7222. doi:10.1038/ncomms8222
[15] Wang (2018). Role of glutamate and NMDA receptors in Alzheimer’s disease. J Alzheimers Dis. 2017; 57(4): 1041–1048. doi: 10.3233/JAD-160763h
[16] Wenwen et al. (2019). The Effect of Magnesium Deficiency on Neurological Disorders: A Narrative Review Article. Iran J Public Health. 48(3):379-387.
[17] Zhang (2016). Dysfunction of NMDA receptors in Alzheimer’s disease. Neurological Sciences. July 2016, Volume 37, Issue 7, pp 1039–1047[18] Zoutewelle (2017). NMDA en glutamaat. Brandgevaar? Of toch niet? Voedingsgeneeskunde 18(4) 52-53.